№
п/п | Наименование параметра | Формула | Обозначения |
|---|
| 2.1 | Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона) | 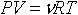 | Р ― давление, V ― объем, ν ― количество молей газа, R = 8,31 Дж/(К∙моль) ― молярная газовая постоянная, Т ― термодинамическая температура |
| 2.2 | Число молекул, скорости которых находятся в интервале от v до v+dv | 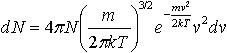 | N ― количество всех молекул, m ― масса одной молекулы, k ― постоянная Больцмана, Т ― термодинамическая температура, v ― скорость молекулы |
| 2.3 | Средняя арифметическая скорость молекул | 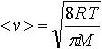 | R = 8,31 Дж/(К∙моль) ― молярная газовая постоянная, Т ― термодинамическая температура, М ― молярная масса газа |
| 2.4 | Средняя квадратичная скорость молекул | 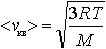 | R = 8,31 Дж/(К∙моль) ― молярная газовая постоянная, Т ― термодинамическая температура, М ― молярная масса газа |
| 2.5 | Наиболее вероятная скорость молекул | 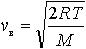 | R = 8,31 Дж/(К∙моль) ― молярная газовая постоянная, Т ― термодинамическая температура, М ― молярная масса газа |
| 2.6 | Длина свободного пробега молекулы | 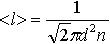 | d ─ эффективный диаметр молекулы, n = p/(kT) ― концентрация молекул газа, k = 1,38∙10–23 Дж/К ― постоянная Больцмана, Т ― термодинамическая температура |
| 2.7 | Среднее число столкновений в единицу времени | 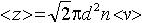 | d ― эффективный диаметр молекулы, n ― концентрация газа, <v> ― средняя арифметическая скорость молекул |
| 2.8 | Коэффициент внутреннего трения газа | 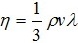 | где ρ — плотность газа;
λ — средняя длина свободного пробега газовых молекул,
v — средняя (арифметическая) скорость их движения. |
| 2.9 | Внутренняя энергия молекул газа | 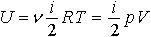 | i ― число степеней свободы молекулы газа |
| 2.10 | Показатель адиабаты | 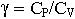 | СР ― молярная теплоемкость при постоянном давлении, СV ― молярная теплоемкость при постоянном объеме |
| 2.11 | При изотермическом процессе | 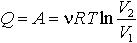 | ν ― количество газа, R = 8,31 Дж/(К∙моль) ― молярная газовая постоянная, Т ― термодинамическая температура, V1 и V2 ― начальный и конечный объем |
| 2.12 | При изобарическом процессе: работа A
теплота
изменение внутренней энергии |
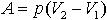 или или
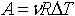
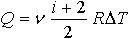
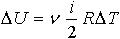 |
р ― давление, V1 и V2 ― начальный и конечный объем
ν ― количество молей газа, R = 8,31 Дж/(моль∙К) ― молярная газовая постоянная, ΔТ ― разность температур
i ― число степеней свободы одной молекулы |
| 2.13 | При изохорном процессе | 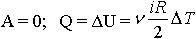 | i ― число степеней свободы молекулы, ν ― количество молей газа, R = 8,31 Дж/(моль∙К) ― молярная газовая постоянная, ΔТ ― разность температур |
| 2.14 | При адиабатическом процессе | 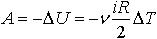 | ν ― количество газа, i ― число степеней свободы молекулы, R = 8,31 Дж/(К∙моль) ― молярная газовая постоянная, ΔТ ― разность температур |
| 2.15 | Распределение Больцмана (частиц в силовом поле) | 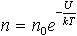 | n ― концентрация частиц; U ― их потенциальная энергия; n0 ― концентрация частиц в точках поля, где U = 0; k ― постоянная Больцмана; Т ― термодинамическая температура газа |
| 2.15a | Зависимость концентрации газов от высоты, если в качестве уровня, где U = 0, выбрать поверхность Земли | 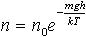 | n0 ― концентрация частиц на высоте h = 0; m ― масса молекулы; g ― ускорение свободного падения; h ― высота над поверхностью Земли; k ― постоянная Больцмана; Т ― термодинамическая температура газа |
| 2.16 | Барометрическая формула | 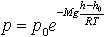 | где p — давление газа в слое, расположенном на высоте h, p0 — давление на нулевом уровне h0, M — молярная масса газа, R — газовая постоянная, T — абсолютная температура |
| 2.17 | Кинетическая энергия, приходящаяся на одну степень свободы молекулы | 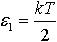 | k = 1,38∙10−23 Дж/К ― постоянная Больцмана, T — абсолютная температура газа |
| 2.18 | Теплоемкость газа
Изменение внутренней энергии газа
Приращение работы | 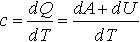
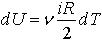
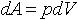 | dQ ― изменение теплоты газа; dA ― приращение работы, выполненной газом; dU ― изменение внутренней энергии газа; dT ― изменение температуры газа
ν ― количество молей газа, i ― число степеней свободы молекулы, R ― молярная газовая постоянная
p ― давление газа, dV ― изменение объема |
| 2.19 | Удельная теплоемкость смеси:
при постоянном давлении
при постоянном объеме | 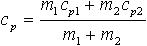
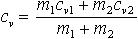 | m1, m2 ― массы составляющих смеси; cp1, cp2 ― удельные теплоемкости составляющих смеси при постоянном давлении; cv1, cv2 ― удельные теплоемкости составляющих смеси при постоянном объеме |
| 2.20 | Молярная теплоемкость смеси | 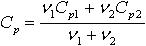
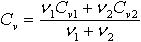 | ν1, ν2 ― количества молей составляющих смеси; Сp1, Сp2 ― молярные теплоемкости составляющих смеси при постоянном давлении; Сv1, Сv2 ― молярные теплоемкости составляющих смеси при постоянном объеме |
| 2.21 | Изменение энтропии при изотермическом процессе | 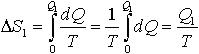 | Q1 ― полученная теплота; T ― термодинамическая температура |
| 2.22 | Изменение энтропии | 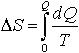 | Q ― полученная теплота; T ― термодинамическая температура |
| 2.23 | Распределение молекул по энергиям | 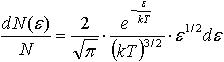 | k ― постоянная Больцмана, T ― термодинамическая температура, ε ― энергия молекулы |
| 2.24 | Распределение молекул по скоростям | 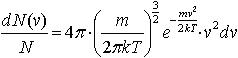 | k ― постоянная Больцмана, T ― термодинамическая температура, m ― масса молекулы, v ― скорость молекулы |
| 2.25 | Теплота, затраченная на нагревание воды массы m от t1 до t2 равна | 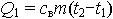 | св = 4183 Дж/(кг∙К) ― удельная теплоемкость воды, m ― масса воды, t2−t1 ― разность температур |
| 2.26 | Теплота, затраченная на испарение воды массы m, равна | 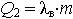 | λв = 2250∙103 Дж/кг ― удельная теплота парообразования для воды, m ― масса воды |
| 2.27 | Молярная масса смеси газов | 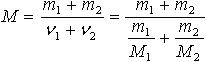 | m1, m2 ― массы составляющих смеси; M1, M2 ― массы составляющих смеси |